Skleněná elektroda/podrobnosti: Porovnání verzí
(doplnění vzorce) |
(dokončeno) |
||
| Řádek 1: | Řádek 1: | ||
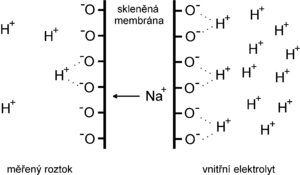
[[Soubor:Membrána skleněné elektrody.png | thumb | Pochody na membráně skleněné elektrody]] | [[Soubor:Membrána skleněné elektrody.png | thumb | Pochody na membráně skleněné elektrody]] | ||
Na poměrně pravidelnou křemičitanovou krystalovou mřížku skla se elektrostatickými silami váží ionty, především vodíku a alkalických kovů (zejména sodíku). Při styku s roztokem se na povrchu vytváří solvatovaná vrstvička, ve které dochází k výměně vodíkových iontů (ale také např. sodíku) mezi roztokem a sklem. | Na poměrně pravidelnou křemičitanovou krystalovou mřížku skla se elektrostatickými silami váží ionty, především vodíku a alkalických kovů (zejména sodíku). Při styku s roztokem se na povrchu vytváří solvatovaná vrstvička, ve které dochází k výměně vodíkových iontů (ale také např. sodíku) mezi roztokem a sklem. | ||
| Řádek 17: | Řádek 15: | ||
Úpravou dostaneme | Úpravou dostaneme | ||
:<math> E = konst - 2,303 \cdot pH </math>. | |||
Potenciál indikační elektrody je tedy lineárně závislý na pH měřeného roztoku. V reálných podmínkách poroste napětí na elektrodě s rostoucím pH o něco pomaleji, než by odpovídalo teoretickým předpokladům. Pro korekci takovýchto odchylek se provádí u pH-metrů kalibrace (ve dvou či více hodnotách pH) a automaticky se podle ní vypočítává směrnice kalibrační přímky (angl. ''slope'', citlivost elektrody), současně se provádí i korekce na teplotu. Poměr skutečné a teoretické směrnice se za optimálních podmínek pohybuje kolem 98 %, s opotřebením a znečištěním elektrody klesá. Při hodnotách pod 95 % je třeba elektrodu vyčistit a stanoveným postupem ošetřit. | Potenciál indikační elektrody je tedy lineárně závislý na pH měřeného roztoku. V reálných podmínkách poroste napětí na elektrodě s rostoucím pH o něco pomaleji, než by odpovídalo teoretickým předpokladům. Pro korekci takovýchto odchylek se provádí u pH-metrů kalibrace (ve dvou či více hodnotách pH) a automaticky se podle ní vypočítává ''směrnice kalibrační přímky'' (angl. ''slope'', citlivost elektrody), současně se provádí i korekce na teplotu. Poměr skutečné a teoretické směrnice se za optimálních podmínek pohybuje kolem 98 %, s opotřebením a znečištěním elektrody klesá. Při hodnotách pod 95 % je třeba elektrodu vyčistit a stanoveným postupem ošetřit. | ||
Známe-li funkci skleněné elektrody, je snadné vysvětlit některé chyby skleněné elektrody. '''Alkalická (pozitivní) chyba''' je způsobená tím, že selektivita skleněné elektrody není ideální. Při velmi nízkých koncentracích <chemform>H+</chemform>, tj. v silně alkalické oblasti, začnou hrát roli i přítomné ionty <chemform>Na+</chemform>. Podle použitého skla a kvality jeho zpracování se sodíková chyba projevuje při pH roztoku nad 8–14, změřené pH bude nižší, než skutečné. Uvádí se, že při práci s roztoky o pH kolem 10 a s koncentrací <chemform>Na+</chemform> 0,1 mol·l<sup>-1</sup> se změřená hodnota může lišit od skutečného pH až o 0,4. V silně kyselém prostředí (pH pod l–2) naopak dojde k nasycení povrchu skla protony a elektroda přestane být k dalšímu snižování pH citlivá, tj. naměříme vyšší výsledek něž by tomu mělo být ve skutečnosti; v tomto případě mluvíme o '''kyselé (negativní) chybě''' (pH < 1). | Známe-li funkci skleněné elektrody, je snadné vysvětlit některé chyby skleněné elektrody. '''Alkalická (pozitivní) chyba''' je způsobená tím, že selektivita skleněné elektrody není ideální. Při velmi nízkých koncentracích <chemform>H+</chemform>, tj. v silně alkalické oblasti, začnou hrát roli i přítomné ionty <chemform>Na+</chemform>. Podle použitého skla a kvality jeho zpracování se sodíková chyba projevuje při pH roztoku nad 8–14, změřené pH bude nižší, než skutečné. Uvádí se, že při práci s roztoky o pH kolem 10 a s koncentrací <chemform>Na+</chemform> 0,1 mol·l<sup>-1</sup> se změřená hodnota může lišit od skutečného pH až o 0,4. V silně kyselém prostředí (pH pod l–2) naopak dojde k nasycení povrchu skla protony a elektroda přestane být k dalšímu snižování pH citlivá, tj. naměříme vyšší výsledek něž by tomu mělo být ve skutečnosti; v tomto případě mluvíme o '''kyselé (negativní) chybě''' (pH < 1). | ||
Verze z 22. 9. 2009, 22:59
Na poměrně pravidelnou křemičitanovou krystalovou mřížku skla se elektrostatickými silami váží ionty, především vodíku a alkalických kovů (zejména sodíku). Při styku s roztokem se na povrchu vytváří solvatovaná vrstvička, ve které dochází k výměně vodíkových iontů (ale také např. sodíku) mezi roztokem a sklem.
Skleněná elektroda se tedy liší od většiny ISE tím, že u ní vznik potenciálu není výsledkem redoxních pochodů, nýbrž dějů výměnných, probíhajících mezi ionty v krystalové mřížce skla a ionty v roztoku. Pro rovnováhu na skleněné membráně platí vztah:
Ks je konstanta selektivity, která ukazuje, jak selektivně elektroda reaguje na jeden nebo druhý iont (* značí fázi skla).
Ze vztahů uvedených výše je zřejmé, že pro potenciál indikační elektrody bude (zjednodušeně) platit
(„konst“ neodpovídá přesně standardnímu redukčnímu potenciálu, ale zahrnuje v sobě i druh a složení skla, způsob přípravy elektrody, kvalitu povrchu i vnitřní náplň elektrody).
Úpravou dostaneme
- .
Potenciál indikační elektrody je tedy lineárně závislý na pH měřeného roztoku. V reálných podmínkách poroste napětí na elektrodě s rostoucím pH o něco pomaleji, než by odpovídalo teoretickým předpokladům. Pro korekci takovýchto odchylek se provádí u pH-metrů kalibrace (ve dvou či více hodnotách pH) a automaticky se podle ní vypočítává směrnice kalibrační přímky (angl. slope, citlivost elektrody), současně se provádí i korekce na teplotu. Poměr skutečné a teoretické směrnice se za optimálních podmínek pohybuje kolem 98 %, s opotřebením a znečištěním elektrody klesá. Při hodnotách pod 95 % je třeba elektrodu vyčistit a stanoveným postupem ošetřit.
Známe-li funkci skleněné elektrody, je snadné vysvětlit některé chyby skleněné elektrody. Alkalická (pozitivní) chyba je způsobená tím, že selektivita skleněné elektrody není ideální. Při velmi nízkých koncentracích <chemform>H+</chemform>, tj. v silně alkalické oblasti, začnou hrát roli i přítomné ionty <chemform>Na+</chemform>. Podle použitého skla a kvality jeho zpracování se sodíková chyba projevuje při pH roztoku nad 8–14, změřené pH bude nižší, než skutečné. Uvádí se, že při práci s roztoky o pH kolem 10 a s koncentrací <chemform>Na+</chemform> 0,1 mol·l-1 se změřená hodnota může lišit od skutečného pH až o 0,4. V silně kyselém prostředí (pH pod l–2) naopak dojde k nasycení povrchu skla protony a elektroda přestane být k dalšímu snižování pH citlivá, tj. naměříme vyšší výsledek něž by tomu mělo být ve skutečnosti; v tomto případě mluvíme o kyselé (negativní) chybě (pH < 1).
Je také zřejmé, že přesuny iontů na membráně jsou relativně pomalé, zvláště za přítomnosti koloidních látek v měřeném roztoku, z čehož vyplývá poměrně dlouhá doba do ustálení elektrody – zpravidla kolem 15 až 60 s (v kyselých roztocích jsou odezvy rychlejší než v alkalických).
Další chyby měření mohou být způsobené vlastnostmi měřených roztoků a manipulací s elektrodou. Pokud elektroda oschne, poškodí se povrchová vrstvička hydratovaného gelu a její obnovení trvá řadu hodin. Rovněž některé látky se mohou na gel vázat a ovlivnit jeho vlastnosti („otrávení elektrody“). Důsledky mechanických nečistot na membráně není třeba rozebírat.